Un equipo de investigadores de la Universidad de Barcelona (UB) y de la Universidad Técnica de Viena (TU Wien, Austria) ha encontrado un efecto catalizador que puede hacer más efectivos los convertidores catalíticos de los vehículos y reducir así las emisiones de monóxido de carbono (CO).
Los resultados de la investigación, publicados recientemente en Nature Materials, se han obtenido a partir de los experimentos que ha llevado a cabo el grupo del profesor Günther Rupprechter de TU Wien, y que se han interpretado utilizando los modelos computacionales creados por el grupo que lidera el profesor Konstantin Neyman, investigador ICREA del Instituto de Química Teórica y Computacional de la Universidad de Barcelona (IQTCUB).
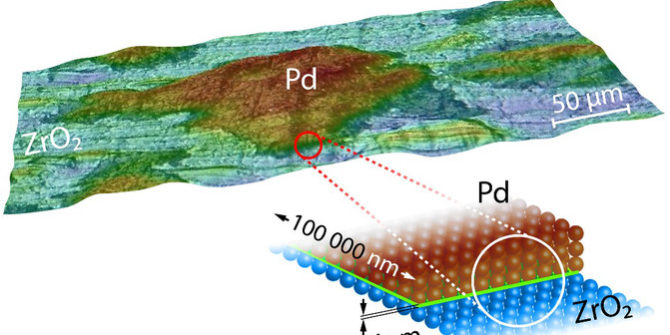
Para modificar los gases de escape, los catalizadores que se utilizan en los automóviles emplean partículas microcristalinas de paladio. En sus experimentos, el equipo ha constatado que los procesos químicos que tienen lugar en dichas partículas cambian de forma significativa cuando estas se colocan sobre soportes de óxido, aunque estos no sean activos en la reacción química. Estos resultados contradicen lo que hasta ahora se pensaba sobre el funcionamiento de este tipo de catálisis.
Del mismo modo que el sabor de la cobertura de un pastel de chocolate no debería depender de si se ha servido en un plato de porcelana o de plata, en las reacciones químicas en la superficie de grandes partículas de metal, el sustrato o soporte no debería tener un papel crucial. Las partículas catalíticas suelen tener un diámetro de miles de átomos, y hasta ahora se creía que el soporte sobre el que se encuentran no afectaba a las reacciones químicas situadas lejos de la superficie de contacto o interfaz.
Intoxicación por monóxido de carbono tóxico
En los vehículos con motor de combustión, el monóxido de carbono (CO) se convierte en dióxido de carbono (CO2) gracias a los catalizadores que contienen paladio o platino. En este proceso, la superficie de las partículas del catalizador se cubre con átomos de oxígeno, por lo que las moléculas de CO reaccionan y se transforman en CO2, dejando lugares vacíos en la capa de oxígeno. Estos lugares deben llenarse rápidamente con otros átomos de oxígeno para que la catálisis se mantenga.
Sin embargo, esto no ocurre cuando son las moléculas de CO (en lugar de las de oxígeno) las que llenan los vacíos. Si eso sucede a gran escala, la superficie del catalizador queda cubierta por una capa de CO y no por una capa de oxígeno, y por tanto, ya no se puede formar CO2. «Podríamos decir que el estado del catalizador se ha desactivado o que ha quedado ‘intoxicado’ por el monóxido de carbono«, aclara el profesor Neyman.
Esta situación se da en función de la concentración de CO en el gas de escape suministrado al catalizador. Sin embargo, los experimentos muestran que el material donde se colocan las partículas de paladio es crucial.
Fuente: SINC
Accede a la información completa aquí